
Introduction
|
Partie IV: Niveau génétique Allons plus loin pour découvrir les mécanismes génétiques de l’horloge biologique. Expérience: En 1970, à l’Institut de technologie de Californie, Ron Konopka et Seymour Benzer, ont réalisé leurs études sur des drosophiles. Ils ont observé 2000 mouches élevées dans 2 incubateurs à l’intérieur desquels la lumière suivait un rythme périodique (lever et coucher de soleil), et où l’on introduisait de la nourriture et de l’air. Résultat: la plupart des animaux gardaient un rythme circadien normal de 24 heures avec 12 heures d’activité et autant de repos ; mais 3 mouches développèrent un comportement anormal dû à des mutations, qui se traduisit soit par un cycle de 19 heures, soit un de 28 heures, et même par l’absence de cycle. Quels étaient les gènes endommagés? En 1984, 3 équipes identifient le gène muté : il s’agit du gène per (period) situé sur le chromosome X. Les 3 mouches possédaient 3 altérations différentes de ce même gène. Ces différentes mutations provoquent selon les cas un raccourcissement ou un rallongement de la période des rythmes physiologiques ou même leur abolition. On s’est aperçu qu’au cours d’un cycle 12 heures de lumière/12 heures d’obscurité, l’ARNm de per est présent en faible quantité au début du jour et à un taux très élevé au début de la nuit. Ce gène détermine la périodicité circadienne et la valeur exacte de cette période. Agit-il seul? L’étude se porta sur l’observation de 7000 mouches. Une mouche dépourvue de rythme circadien fut isolée. La mutation était située sur le chromosome 2 : découverte du gène tim (timeless) en 1994. Son expression suit les mêmes variations que per. A partir des gènes per et tim, on synthétisa les protéines PER et TIM. On remarqua ensuite que, réunies dans une même solution, ces 2 protéines se liaient. Chez les drosophiles mutantes tim (qui ne peuvent donc plus fabriquer la protéine TIM), les oscillations circadiennes de l’ARNm de per sont supprimés ; inversement si l’on empêche l’organisme de produire la protéine PER. En effet PER et TIM, lorsqu’elles atteignent un niveau élevé dans le cytoplasme, s’associent en dimère, transféré dans le noyau qui inhibe l’expression des gènes per et tim. Au bout de quelques heures, les enzymes dégradent les dimères PER-TIM et les gènes peuvent à nouveau produire leur protéine : un nouveau cycle commence. En 1997, les équipes de Hajime Tei (Université de Tokyo), de Hitoshi Okamura (Université de Kobe), et de Cheng Chi Lee (Collège de médecine Baylor), isolèrent les analogues du gène per chez la souris et l’homme. Un an plus tard, on trouva les analogues du gène tim. Une importante découverte suivit : ces gènes présents dans toutes les cellules s’expriment dans le noyau suprachiasmatique. Comment sont-ils activés? En 1997, Joseph Takahashi et ses confrères de l’Institutmédical Howard Hugues, isolent chez la souris, la drosophile et encore bien d‘autres mammifères, le gène clock, qui, lorsqu’il est muté supprime le rythme circadien. D’après sa structure, la protéine CLOCK est un facteur de transcription. Les expériences réalisées chez les drosophiles et les souris ont confirmé l’hypothèse selon laquelle CLOCK, associée à une protéine appelée CYCLE chez la drosophile et BMALI chez la souris, stimule la transcription des gènes per et tim. Depuis peu, Steeve Reppert et l’Université de Haward, explorent des signaux spécifiques qui relient les horloges biologiques de la souris et de divers comportement modulés par ces horloges. L’hypothèse actuellement retenu par les scientifiques est donc que l’inhibition de la transcription de per et tim par le dimère PER-TIM s’effectue via l’inhibition de CLOCK. De plus, selon une étude menée en 1998, le dimère PER-TIM peut aussi stimuler la transcription du gène clock. Mais pour l’heure, les scientifiques ne savent pas comment PER-TIM peut jouer deux rôles assez différents. Les 4 gènes vus précédemment constituent le coeur de l’horloge biologique des mouches et avec quelques modifications celle de la plupart des animaux. Mais il semble difficile d’imaginer que seuls 4 protéines PER, TIM, CLOCK et CYCLE gèrent tous les mécanismes de l’horloge biologique. En 1998, après la découverte de la protéine DOUBLETIME, le système s’est révélé plus complexe. DOUBLETIME est une kinase, une protéine qui, par une réaction de phosphorylation, peut ajouter un groupement phosphate sur d’autres protéines. Ainsi DOUBLETIME phosphoryle PER ce qui la rend instable et l’empêche de former un dimère avec TIM. On a aussi découvert la protéine CRY. Cette protéine appartient à la famille de cryptochromes, molécules réceptrices de lumière. Chez la drosophile, CRY, exposée à la lumière, se lie à TIM alors rendue incapable de former un dimère avec PER. En somme, DOUBLETIME et CRY en agissant modifient la disponibilité des 2 protéines centrales de l’horloge. De plus, CRY n’a pas la même fonction chez la souris que chez la drosophile. En effet, chez la souris, CRY se substitue à TIM pour former un dimère PER-CRY fonctionnellement identique au dimère PER-TIM de la drosophile. En fait, CRY se trouve selon que l’on étudie la drosophile ou la souris dans 2 rôles opposés : activateur et inhibiteur de la transcription de per. Encore plus petit? Le gène per est subdivisé en per1, per2, et per3. L’expression de ces 3 gènes est commandée par le noyau suprachiasmatique. D’après Norio Ishida à l’Institut Tsukuba, on sait que le gène per2 est exprimé dans les tissus périphériques tel le foie, les poumons, les reins avec un rythme différent selon les tissus. Selon Gijsbertus Van der Horts (Université de Rotterdam), 2 protéines nommées cry1 et cry2 seraient synthétisées dans certaines cellules de la rétine et jouerait un rôle important dans la régulation de l’horloge biologique. Et ailleurs...? Plusieurs autres études ont montré que le cerveau n’était pas le seul responsable des rythmes circadiens. Les scientifiques se sont aperçus que lorsqu’ils mettaient en culture un organe de la drosophile, les cellules de celui-ci gardaient un rythme circadien. On a donc admis la présence d’horloges périphériques chez la drosophile (antennes, région buccale, pattes, ailes, tubules malpighiens...). Mais peut-on affirmer la même chose chez les vertébrés ? On a prouvé que oui. En effet, on observe des rythmes circadiens dans les organes isolés comme par exemple chez le poisson zèbre, petit poisson couramment utilisé par les généticiens. Chez lui l’expression du gène homologue à clock oscille de façon circadienne dans presque tous les tissus. On sait également que le coeur et le rein mis en culture (séparés du reste du corps) manifestent des rythmes circadiens pendant plusieurs jours. Ce résultat qui peut être étendu à toutes les cellules du poisson zèbre prouve donc que les tissus peuvent agir indépendamment. De plus, les rythmes de ces organes ex vivo ou de ces cellules sont régulés par la lumière ce qui amène à penser qu’il existe des photorécepteurs dans ces tissus. Les scientifiques ne les ont malheureusement pas encore découverts. Quant aux mammifères il semble, d’après des expériences faites sur des rats, qu’ils ont eux aussi des horloges périphériques. A l’heure actuelle les scientifiques cherchent encore le rôle physiologique de ces horloges périphériques. Fonctionnent-elles vraiment indépendamment des horloges centrales ou à l’inverse sont-elles de simples oscillations coordonnées par ses dernières. Le débat reste ouvert. Notons que récemment on s’est aperçu que les drosophiles auxquelles on avait supprimé les horloges périphériques ne manifestaient plus d’oscillation de leur capacité olfactive. Existe-t-il chez l’homme un lien direct entre gènes de l’horloge biologique et pathologie ? D’après une étude récente, un nucléotide du gène clock humain varie d’un individu à l’autre et cette variation semble liée avec le temps du sommeil. Des études sont encore en cours. 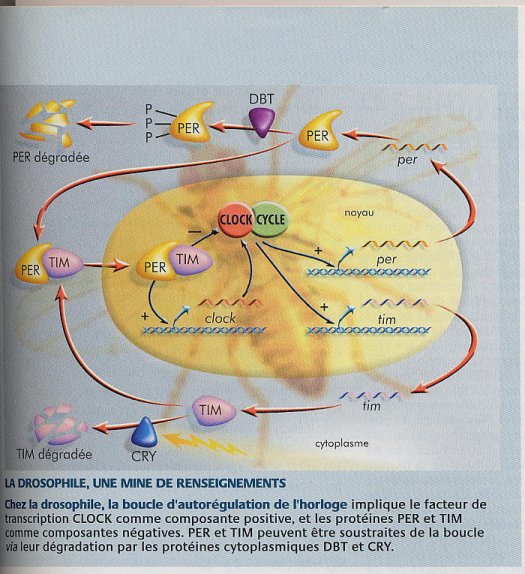
|